Approche multidisciplinaire des obstructions urétérales chez le chat
Dans une optique de partage et d’échange pluridisciplinaire, nous avons organisé en interne un Journal Club interservices ayant pour objectif améliorer notre prise en charge globale des chats présentant des obstructions urétérales. Les équipes d’imagerie, médecine et chirurgie doivent travailler ensemble pour optimiser la gestion de ces patients.
Auteurs: Mathieu Faucher, Anaïs Combes, Annaëlle Saucet-Zerbib, Adriana Navarro, Charlotte Gillot, Céline Lebout, Charlotte Vallin, Elise Vard, Madeline Forissier
- Diagnostic des obstructions urétérales
Dans un contexte d’insuffisance rénale aigue, il est important d’en déterminer la cause pour pouvoir la traiter. L’imagerie médicale doit permettre de déterminer si l’uretère est obstrué, quelle serait la cause de l’obstruction (calcul, sténose, caillot, néoplasie) et où elle se situerait. Dans les cas d’obstruction urétérale, l’imagerie permet d’opter pour un traitement médical et/ou chirurgical, et le cas échéant, de choisir la technique chirurgicale optimale.
L’objectif des études est d’identifier des critères cliniques, radiographiques, échographiques et tomodensitométriques associés à une obstruction urétérale ou à son pronostic, chez les chats en insuffisance rénale aigue.
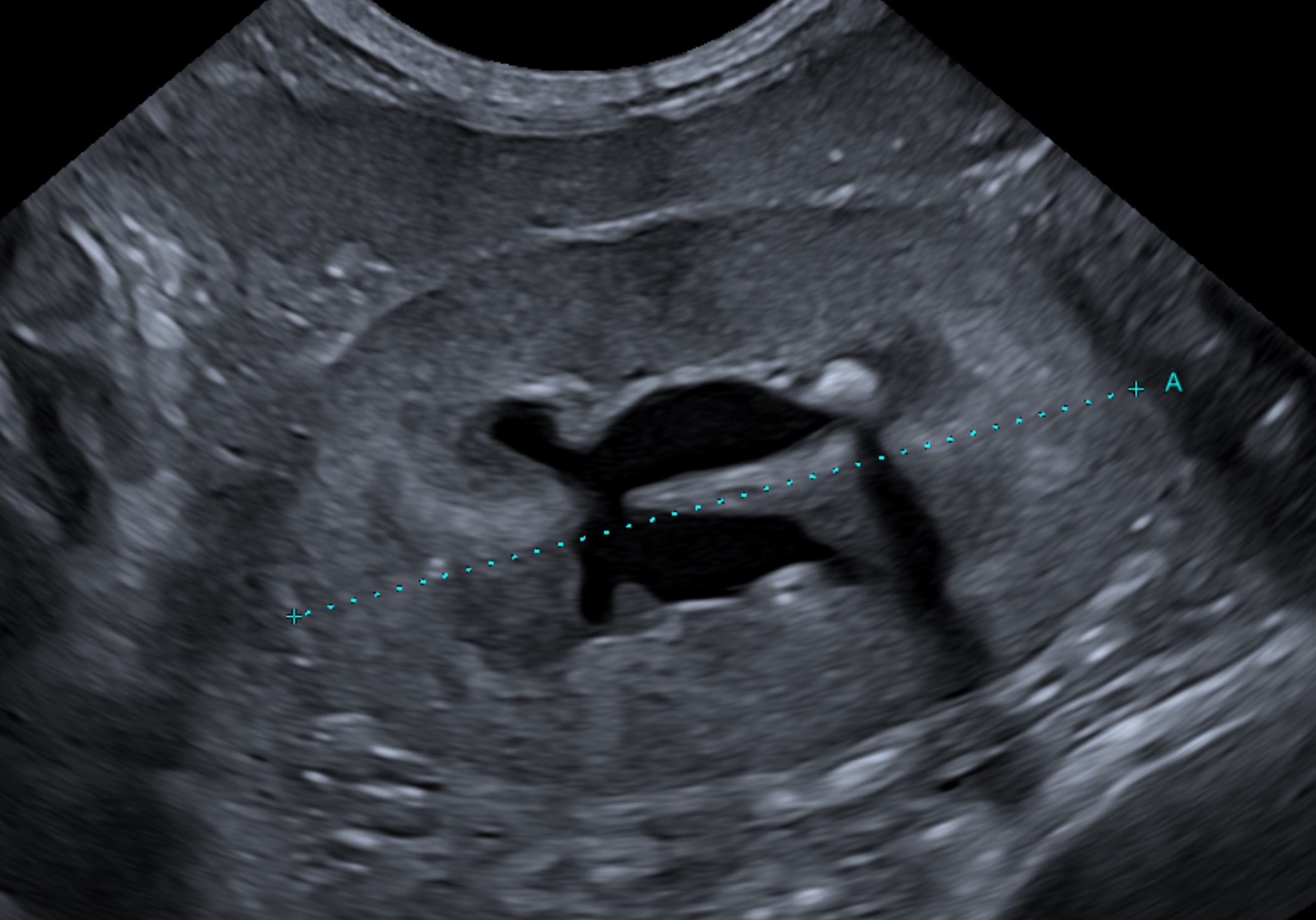
Dans l’étude Lamb et al. 2017, la suspicion échographique d’obstruction urétérale est fondée sur une néphromégalie unilatérale, une dilatation pyélique et un calcul urétéral, identifiés chez 92 chats. Seuls 49/92 chats ont subi une pyélographie antérograde complémentaire qui permet de confirmer le diagnostic d’obstruction urétérale. Au final, aucun critère échographique ne permet de faire la différence entre les uretères obstrués et les uretères non-obstrués d’après la pyléographie antérograde.
Dans une comparaison des critères échographiques avec le diagnostic per-opératoire, la concordance est seulement modérée. L’échographie s’avère assez sensible et spécifique dans le diagnostic des obstructions par calculs mais en revanche, très peu sensible dans le diagnostic des sténoses et des caillots sanguins urétéraux.
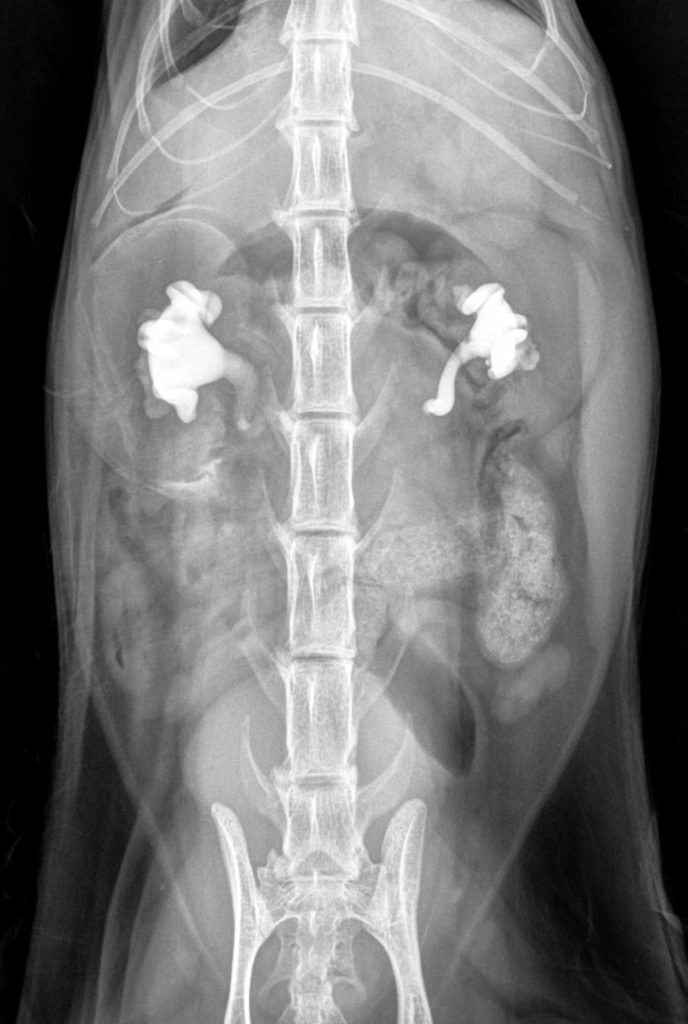
L’examen tomodensitométrique sans produit de contraste (néphrotoxicité potentielle) et sans anesthésie générale est un outil prometteur dans le diagnostic des calculs urétéraux (Testault et al., 2021). Mais son efficacité dans la définition du caractère obstructif de ces calculs reste à déterminer. En effet, cela conditionne le choix du traitement médical ou chirurgical de l’insuffisance rénale aigue.
- Traitement médical
Le traitement médical de l’obstruction urétérale est habituellement proposé initialement pendant 24-72h. Il comprend une fluidothérapie, une myorelaxation (par des alpha-bloquants la plupart du temps), une analgésie. Au cas par cas des diurétiques, des antibiotiques ou des corticoïdes sont administrés. Le traitement médical est rarement couronné de succès sur le court terme (<10% des cas). Dans le cas où il est poursuivi plus longtemps (en général lorsque le traitement interventionnel est décliné) le taux de succès est meilleur (environ 30%). Des calculs de petite taille, en portion distale de l’uretère ou associés à une créatininémie plus basse sont associés à de meilleures chances de succès du traitement médical.
- Traitement chirurgical
En cas d’échec du traitement médical, la présence d’un calcul urétéral obstructif chez le chat nécessite une intervention chirurgicale. Pratiquée le plus précocement possible elle a pour but d’éviter ou de ralentir l’évolution des lésions du parenchyme rénal, irréversibles.
Plusieurs techniques existent et se regroupent en deux familles.
D’un côté il existe les techniques visant à conserver l’uretère originel : le stent urétéral, l’urétérotomie et la néourétérocystotomie end-to-side.
De l’autre côté celles visant à court-circuiter l’uretère : le SUB, la néphrocystotomie la néourétérocystotomie side-to-side.
Les complications générales du traitement chirurgical sont l’uroabdomen, l’anémie, les atteintes urinaires chroniques et la diurèse de levée d’obstruction. L’uroabdomen est un facteur pronostic négatif lors de l’hospitalisation tandis que l’anémie ne l’est pas. Le taux de mortalité à court-terme (postopératoire immédiat ou en hospitalisation) est d’environ 10 % toute technique confondue. La première cause de décès des chats concernés est l’évolution de la maladie rénale chronique.
La présence d’un stent ou d’un cathéter urétéral, augmente significativement le risque de complication, notamment les infections urinaires chroniques. C’est notamment pour cette raison que cette technique n’est plus couramment pratiquée.
La néourétérocystotomie end-to-side est réalisée lorsque le calcul se situe dans le tiers distal, pour des raisons de tension et de vascularisation. Pour palier à cette limite une technique de néourétérocystotomie side-to-side a été développée et donne des résultats prometteurs.
La néphrocystotomie qui consiste à réaboucher directement le pôle caudal du rein à l’apex de la vessie montre un taux de complications assez bas et une bonne faisabilité bien qu’elle nécessite une expérience opératoire suffisante.
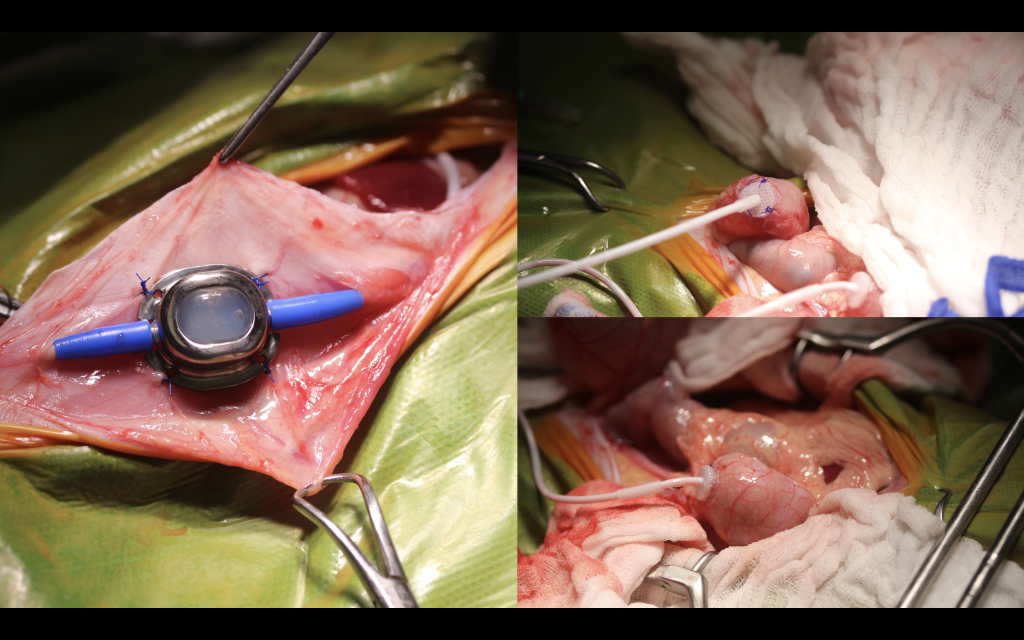
Le « subcutaneous ureteral bypass », ou SUB, est un dispositif qui permet d’acheminer l’urine du rein à la vessie en court-circuitant l’uretère. Depuis plusieurs années, le SUB fait désormais partie de l’arsenal thérapeutique pour la gestion des obstructions urétérales félines car il permet de court-circuiter l’uretère et donc de contourner l’obstruction qu’elle soit liée à des lithiases, des sténoses, des néoplasmes, etc. Comme toute chirurgie, la pose d’un SUB entraine des complications nécessitant le bon suivi de l’animal en post-opératoire. Les deux complications majeures sont les minéralisations et les infections, toutes les deux pouvant entraîner la reprise chirurgicale du SUB. Dans la majorité des études récentes, un taux de survie de plus de 2ans est observé, d’autant plus si le taux de créatinémie préopératoire est inférieur à 440 μmol/L.
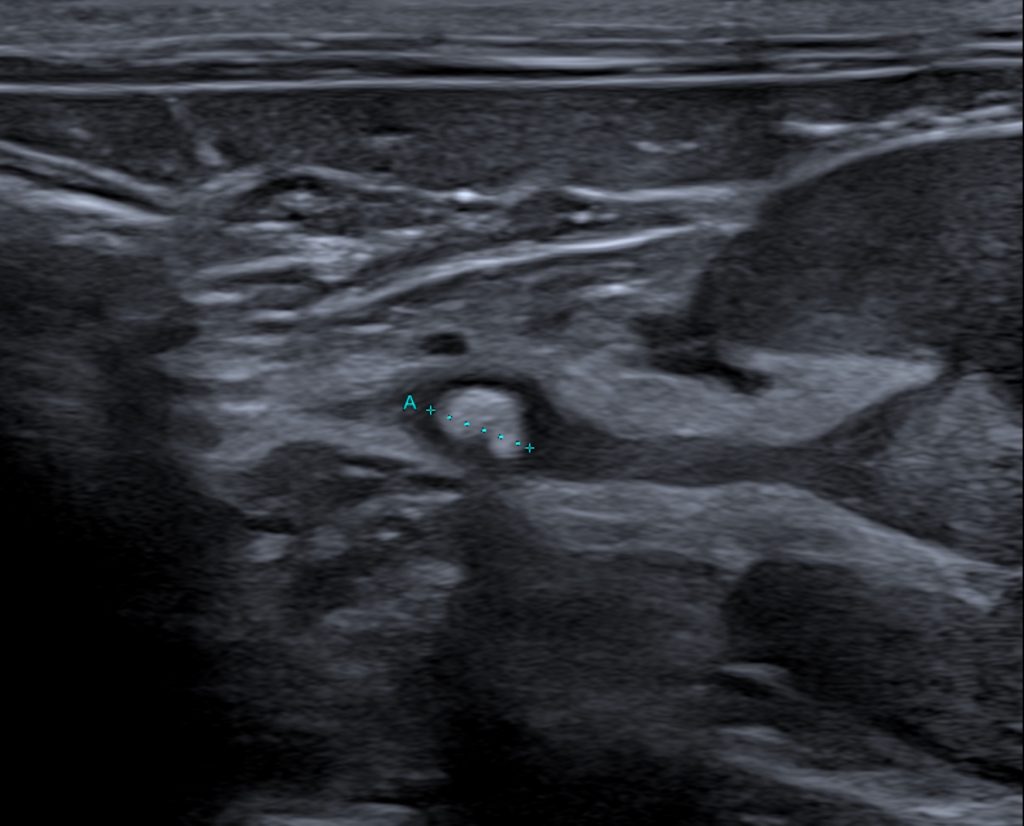
Imagerie de suivi des SUB
Lors de chaque suivi échographique, la perméabilité du système de SUB est évaluée grâce à l’injection de 1 à 2mL de NaCL par le port sous-cutané et la visualisation de microbulles de NaCL dans la vessie et dans le bassinet. L’étude post-opératoire de la taille du bassinet rénal après la mise en place d’un SUB montre une nette diminution de la dilatation pyélique. Un bassinet mesuré à plus de 5mm en post-opératoire de SUB doit donc laisser suspecter une complication obstructive. Aucune autre différence significative échographique n’est répertoriée.
Afin d’évaluer la perméabilité du système de SUB en fluoroscopie, 1 à 3mL de produit de contraste sont injectés dans le port sous-cutané, puis des radiographies sont réalisées. Le système est considéré comme perméable si toute sa lumière est remplie par le produit de contraste et que du produit de contraste est visualisé dans le bassinet et la vessie. Les anomalies répertoriées dans cet article sont l’obstruction du cathéter de néphrostomie ou de cystotomie par une coudure ou une cause indeterminée, une coudure du système sans obstruction et des fuites du système. Selon les auteurs, l’échographie doit être privilégiée pour le suivi de la taille de la cavité pyélique, mais la fluoroscopie doit être utilisée pour identifier une fuite, un site d’obstruction ou une coudure du système de SUB.
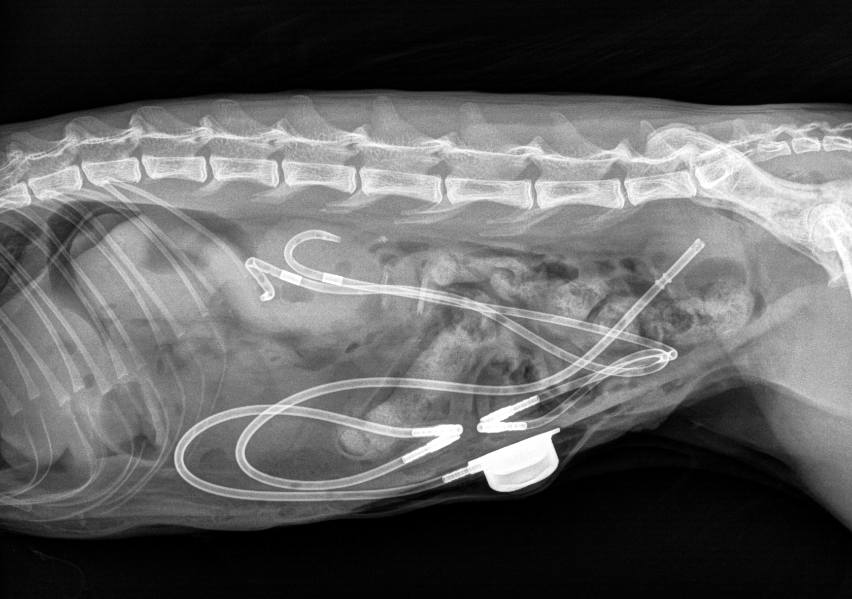
Complications des SUB
- Les infections du tractus urinaire
Lors de la mise en place d’un dispositif de dérivation pyélovésicale (SUB) ou d’un stent urétéral, le développement d’une infection urinaire en post-opératoire est rapporté dans 27 à 35% des cas. Les bactéries les plus fréquemment isolées sont E.coli ou Enteroccocus spp.; une infection ascendante est donc probablement en cause dans la plupart des cas. Des études ont permis de mettre en évidence qu’une antibiothérapie post-opératoire de 5 jours et une température rectale en sortie de chirurgie plus haute étaient associés à un risque inférieur de développer une infection du tractus urinaire. Également, une culture bactérienne positive ou une bactériurie pendant l’intervention chirurgicale de mise en place du dispositif SUB étaient associées à un risque supérieur de présenter une bactériurie au cours de la période post-opératoire et de développer une infection urinaire persistante. Une antibiothérapie permet de traiter avec succès l’infection urinaire dans la plupart des cas. Les infections urinaires en échec de traitement, les infections causées par des germes multirésistants sont gérées au cas par cas : remplacement du dispositif, abandon du traitement médical.
- Les obstructions du dispositif
L’étude de Dropkin at al .de 2021, présente une série de cas s’intéressant à 7 chats qui souffrent d’une obstruction post-opératoire de SUB par des caillots sanguins. L’utilisation d’altéplase (un activateur tissulaire du plasminogène) permet de rétablir une bonne perméabilité chez tous les chats en 2 jours sans complication associée. Cette série de cas suggère qu’une perfusion d’altépase doit être envisagée avant l’intervention chirurgicale afin de prévenir l’occlusion post-opératoire des dispositifs SUB. Les articles de Chik at al. De 2019 et Duval at al. de 2022 étudient des protocoles d’instillation d’EDTA tétrasodique à 2% et 4% pour la levée des obstructions minéralisées des dispositifs SUB. Les résultats sont favorables avec une désobstruction de tous les SUB dans la première étude (8/8) et 68,8% de succès dans la deuxième étude (11/16). Des récidives sont cependant observées (2 cas sur 8 dans la première étude et 6 cas sur 11 dans la deuxième étude avec une médiane à 87 jours). Les effets secondaires sont mineurs et caractérisés par une pollakiurie et une hématurie auto-résolutive. L’utilisation d’EDTA tetrasodique permet d’éviter le changement prématuré du dispositif SUB en cas d’obstruction minéralisée.
Bibliographie :
Wuillemin F, Vachon C, Beauchamp G, Dunn M. Subcutaneous ureteral bypass device placement in 81 cats with benign ureteral obstruction (2013-2018). J Vet Intern Med. 2021 Nov;35(6):2778-2786.
Butty EM, Labato MA. Subcutaneous ureteral bypass device placement with intraoperative ultrasound guidance, with or without microsurgical ureterotomy, in 24 cats. J Feline Med Surg. 2021 Dec;23(12):1183-1191.
Vrijsen E, Devriendt N, Mortier F, Stock E, Van Goethem B, de Rooster H. Complications and survival after subcutaneous ureteral bypass device placement in 24 cats: a retrospective study (2016-2019). J Feline Med Surg. 2021;23(8):759-769.
Kulendra NJ, Borgeat K, Syme H, Dirrig H, Halfacree Z. Survival and complications in cats treated with subcutaneous ureteral bypass. J Small Anim Pract. 2021 Jan;62(1):4-11.
Berent AC, Weisse CW, Bagley DH, Lamb K. Use of a subcutaneous ureteral bypass device for treatment of benign ureteral obstruction in cats: 174 ureters in 134 cats (2009-2015). J Am Vet Med Assoc. 2018; 253(10):1309-1327.
Livet V, Pillard P, Goy-Thollot I, Maleca D, Cabon Q, Remy D, Fau D, Viguier É, Pouzot C, Carozzo C, Cachon T. Placement of subcutaneous ureteral bypasses without fluoroscopic guidance in cats with ureteral obstruction: 19 cases (2014-2016). J Feline Med Surg. 2017 Oct;19(10):1030-1039.
Oyamada K, Inoue M, Sato-Takada K, Minamoto T, Fujiki M. Extravesicular, two-layer, side-to-side ureteroneocystostomy combined with tension-relieving techniques for feline proximal ureteral obstruction: A retrospective study. Vet Surg. 2023 Oct;52(7):972-982.
Hardie RJ, Schmiedt CW, Gendron KP, Rissi D. Evaluation of two nephrocystostomy techniques for ureteral bypass in cats. Vet Surg. 2023 Oct;52(7):961-971.
Lorange M, Monnet E. Postoperative outcomes of 12 cats with ureteral obstruction treated with ureteroneocystostomy. Vet Surg. 2020 Oct;49(7):1418-1427.
Culp WT, Palm CA, Hsueh C, Mayhew PD, Hunt GB, Johnson EG, Drobatz KJ. Outcome in cats with benign ureteral obstructions treated by means of ureteral stenting versus ureterotomy. J Am Vet Med Assoc. 2016 Dec 1;249(11):1292-1300.
Wormser C, Clarke DL, Aronson LR. Outcomes of ureteral surgery and ureteral stenting in cats: 117 cases (2006-2014). J Am Vet Med Assoc. 2016;248(5):518-25.
Fages J, Dunn M, Specchi S, Pey P. Ultrasound evaluation of the renal pelvis in cats with ureteral obstruction treated with a subcutaneous ureteral bypass: a retrospective study of 27 cases (2010-2015). J Feline Med Surg. 2018;20(10):875-883.
Dirrig H, Lamb CR, Kulendra N, Halfacree Z. Diagnostic imaging observations in cats treated with the subcutaneous ureteral bypass system. J Small Anim Pract. 2020 Jan;61(1):24-31.
Testault I, Gatel L, Vanel M. Comparison of nonenhanced computed tomography and ultrasonography for detection of ureteral calculi in cats: A prospective study. J Vet Intern Med. 2021 Sep;35(5):2241-2248.
Lemieux C, Vachon C, Beauchamp G, Dunn ME. Minimal renal pelvis dilation in cats diagnosed with benign ureteral obstruction by antegrade pyelography: a retrospective study of 82 cases (2012-2018). J Feline Med Surg. 2021 Oct;23(10):892-899.
Etedali NM, Reetz JA, Foster JD. Complications and clinical utility of ultrasonographically guided pyelocentesis and antegrade pyelography in cats and dogs: 49 cases (2007-2015). J Am Vet Med Assoc. 2019 Apr 1;254(7):826-834.
Wormser C, Reetz JA, Drobatz KJ, Aronson LR. Diagnostic utility of ultrasonography for detection of the cause and location of ureteral obstruction in cats: 71 cases (2010-2016). J Am Vet Med Assoc. 2019;254(6):710-715.
Lamb CR, Cortellini S, Halfacree Z. Ultrasonography in the diagnosis and management of cats with ureteral obstruction. J Feline Med Surg. 2018;20(1):15-22.
Kopecny L, Palm CA, Drobatz KJ, Balsa IM, Culp WTN. Risk factors for positive urine cultures in cats with subcutaneous ureteral bypass and ureteral stents (2010-2016). J Vet Intern Med. 2019 Jan;33(1):178-183.
Pennington CE, Halfacree Z, Colville-Hyde C, Geddes RF. Factors associated with positive urine cultures in cats with subcutaneous ureteral bypass system implantation. J Feline Med Surg. 2021 Apr;23(4):331-336.
Deprey J, Baldinger A, Livet V, Blondel M, Taroni M, Lefebvre C, Goy-Thollot I, Moissonnier P, Viguier É, Pouzot-Nevoret C, Carozzo C, Cachon T. Risk factors and clinical relevance of positive urine cultures in cats with subcutaneous ureteral bypass. BMC Vet Res. 2021 May 27;17(1):199.
Djoneva L, Lawson J, Rutherford L, Geddes R. Analysis of lower urinary tract signs and bacteriuria in cats with subcutaneous ureteral bypass systems. Vet Rec Open. 2023 Aug 1;10(2):e69.
Duval V, Dunn M, Vachon C. Use of tetrasodium EDTA acid for the treatment of intraluminal obstruction of subcutaneous ureteral bypass devices. J Feline Med Surg. 2022 Oct;24(10):e330-e337.
Chik C, Berent AC, Weisse CW, Ryder M. Therapeutic use of tetrasodium ethylenediaminetetraacetic acid solution for treatment of subcutaneous ureteral bypass device mineralization in cats. J Vet Intern Med. 2019 Sep;33(5):2124-2132.
Dropkin CA, Burdick SK, Berent AC, Weisse CW. Use of tissue plasminogen activator to alleviate postoperative subcutaneous ureteral bypass obstruction secondary to blood clot in seven cats. J Feline Med Surg. 2021 Oct;23(10):996-1004.
Merindol I, Vachon C, Juette T, Dunn M. Benign ureteral obstruction in cats: Outcome with medical management. J Vet Intern Med. 2023 May-Jun;37(3):1047-1058.
Chae HK, Hong HJ, Lee SY, Park JH, Choi WJ, Oh S, Ji S, Hong YJ. Factors Affecting the Outcome of Medical Treatment in Cats with Obstructive Ureteral Stones Treated with Tamsulosin: 70 Cases (2018-2022). Vet Sci. 2022 Oct 16;9(10):568.
Actualités associées

Prise en charge de la fin de vie avec Animacare
La clinique vétérinaire Alliance est partenaire de la société Anima …

La dysplasie du coude chez le chien
Le terme de « dysplasie » est un terme général qui pourrait êtr…

Vétérinaire Urgentiste de nuit
Notre clinique Alliance est actuellement à la recherche d'un futur vét…